LES TROUBLES DU SOMMEIL : UN FACTEUR DE RISQUE MÉTABOLIQUE TROP MÉCONNU
Jean-Louis SCHLIENGER, Faculté de médecine, université de Strasbourg
La durée et la qualité du sommeil n’ont cessé de diminuer au cours des dernières décennies en raison principalement des modifications du style de vie des sociétés modernes. En France, plus de 1 personne sur 5 présentait des symptômes d’insomnie chronique accompagnés de perturbations diurnes (données ESPS 2008). La prévalence qui semble s’être intensifiée depuis est plus forte chez les femmes que chez les hommes et augmente avec l’âge. Outre l’inconfort diurne (fatigue ou somnolence excessive), l’Insuffisance et la fragmentation du sommeil sont associées à un risque accru d’obésité, de syndrome métabolique et de diabète de type 2 (DT2). Par ailleurs les troubles du sommeil qui sont plus fréquents chez les sujets atteints de diabète pourraient être dus à la maladie elle-même ou à ses complications. L’évaluation de la qualité du sommeil et des troubles du sommeil devrait faire partie de l’examen du DT2(1).
Le sommeil
Le sommeil est un phénomène universel commun à toutes les espèces pluricellulaires, défini par un état d’inactivité réversible associé à une réactivité réduite vis-à-vis de l’environnement extérieur. Il s’agit d’un processus comportemental et physiologique dynamique et actif composé d’une succession de 3 à 6 cycles de 60 à 120 minutes chacun constitué d’une alternance de sommeil lent et de sommeil paradoxal correspondant chacun à une activité cérébrale différente. La phase de sommeil lent caractérisée par des ondes lentes à l’EEG est suivie par une phase de sommeil progressivement plus profond. Le sommeil paradoxal correspond à une période durant laquelle l’activité cérébrale est proche de celle de la phase d’éveil appelée période REM (Rapid Eye Movement), en raison de fréquents mouvements oculaires rapides. Les derniers stades du sommeil lent (non-REM) sont les plus réparateurs. Le sommeil, intégré dans un système homéostatique de sauvegarde des espèces, module un grand nombre de systèmes métaboliques, endocriniens et cardiovasculaires. Le sommeil non paradoxal est marqué par une diminution des métabolismes, de l’activité du système nerveux sympathique, de la pression artérielle et de la fréquence cardiaque et par une augmentation de l’activité vagale cardiaque. Expérimentalement, la privation complète de sommeil entraîne la mort après quelques semaines. Élément important de la santé, le sommeil restaure les fonctions cérébrales en permettant la reconstitution des réserves énergétiques cérébrales et en facilitant la plasticité synaptique. Il intervient dans les phénomènes de concentration, d’apprentissage, de mémorisation ou d’orientation. Une horloge circadienne située dans le noyau suprachiasmatique de l’hypothalamus règle les habitudes de sommeil et d’éveil.
Sommeil et sensibilité à l’insuline chez le sujet sain
L’exploration de la sensibilité à l’insuline a été réalisée dans plusieurs études expérimentales dans le but de préciser la relation existant entre les troubles du sommeil et le métabolisme glucosé chez le sujet sain. La restriction du sommeil à 4 ou 5 heures par nuit pendant environ une semaine entraîne une diminution de la tolérance au glucose et de la sensibilité à l’insuline(2). Une restriction du sommeil de 1,5 heure pendant 3 semaines entraîne une diminution de la sensibilité, réversible du fait de la mise en place de mécanismes compensatoires(3). La fragmentation expérimentale du sommeil pendant deux nuits tout en maintenant un temps de sommeil total constant réduit la sensibilité à l’insuline de 25 %. La suppression spécifique du sommeil lent pendant 3 nuits sans modifier le temps de sommeil total entraîne également une diminution de la sensibilité à l’insuline, ce qui suggère que ce stade du sommeil intervient dans l’homéostasie glucosée(4). Inversement, le rétablissement d’une durée de sommeil normale est associé à une amélioration de la sensibilité à l’insuline. Un sommeil de mauvaise qualité évalué par actimétrie altère la glycémie postprandiale et la courbe de tolérance au glucose lors d’un repas-test. Une méta-analyse et une revue systématique des études contrôlées randomisées aboutissent à la conclusion que les manipulations du sommeil portant sur la limitation de la durée, la qualité de sommeil et sur le désalignement circadien ont un effet néfaste sur les marqueurs de la sensibilité à l’insuline(5).
Durée du sommeil et diabète de type 2
Les données épidémiologiques suggèrent qu’une durée de sommeil anormale, soit insuffisante (< 5 à 6 heures/nuit) soit excessive (> 9 heures/nuit), expose à un risque plus élevé d’obésité et de DT2. Plusieurs études transversales ont rapporté une association entre la durée du sommeil et la résistance à l’insuline dans le DT2, mais peu d’études ont eu recours à des mesures objectives du sommeil. Dans l’étude MESA, où la durée du sommeil a été déduite de mesures actigraphiques, la probabilité d’être diabétique était de 1,3 chez les sujets dont le sommeil était < 5 heures(6). En revanche, dans l’étude CARDIA, il n’a pas été trouvé de relation entre la durée du sommeil estimée par actigraphie et la résistance à l’insuline évaluée par le modèle homéostatique HOMA(7). Dans une étude transversale de population récente comportant une randomisation mendélienne, l’insomnie était significativement associée à une insulinorésistance, mais il n’a pas pu être prouvé de relation causale(8). Les méta-analyses des études prospectives de cohortes concluent à une association entre la durée du sommeil (déclarée) et le DT2 incident selon une courbe en forme de U, le risque le plus faible correspondant à une durée de sommeil nocturne de 7 à 8 heures(9). Quelques études interventionnelles portant sur de petits effectifs se sont intéressées à l’effet d’une durée de sommeil prolongée sur le risque de DT2 sans parvenir à démontrer de modifications des marqueurs du métabolisme glucosé chez des petits dormeurs habituels(10). La relation entre le sommeil et la glycémie a également été démontrée chez le sujet en bonne santé. Selon une méta-analyse, une sieste prolongée (< 1 heure) ou une somnolence diurne sont associées à une augmentation du risque de DT2 avec un RR respectif de 1,46 (1,23-1,74) et 2,00 (1,58-2,53) ; une durée plus courte n’est pas associée à une augmentation du DT2. La relation se fait selon une courbe en J avec un effet protecteur observé pour une sieste de 40 minutes (figure 1)(11).
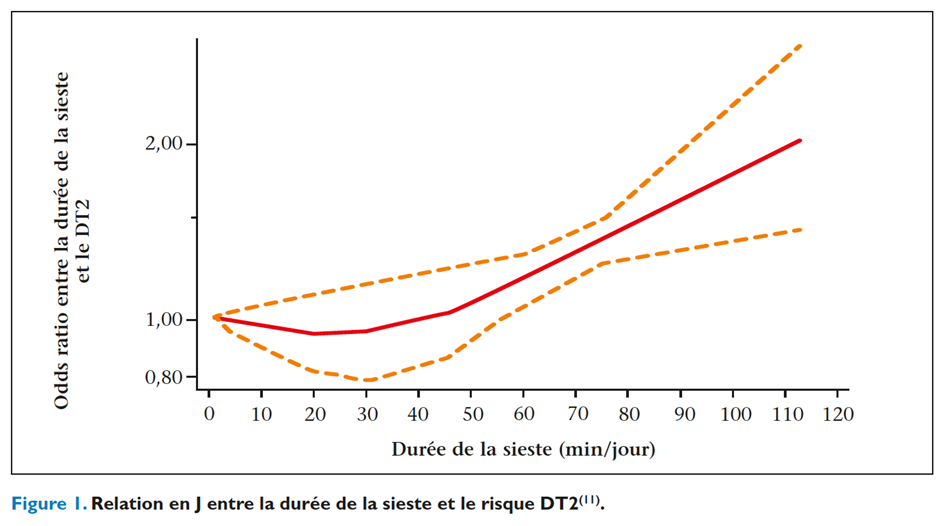
Troubles du sommeil et risque de diabète
Les anomalies qualitatives du sommeil comme l’altération de l’architecture du sommeil, la fragmentation du sommeil, les perturbations du rythme circadien (travail posté) ou le syndrome d’apnées du sommeil sont également associées à un risque plus élevé de DT2. Dans une méta-analyse et revue systématique, la difficulté à s’endormir augmentait le risque de DT2 de 55 % et la difficulté à maintenir le sommeil de 74 %(12). De fait, les troubles du sommeil sont significativement plus fréquents chez les personnes atteintes de diabète que chez les personnes non diabétiques.
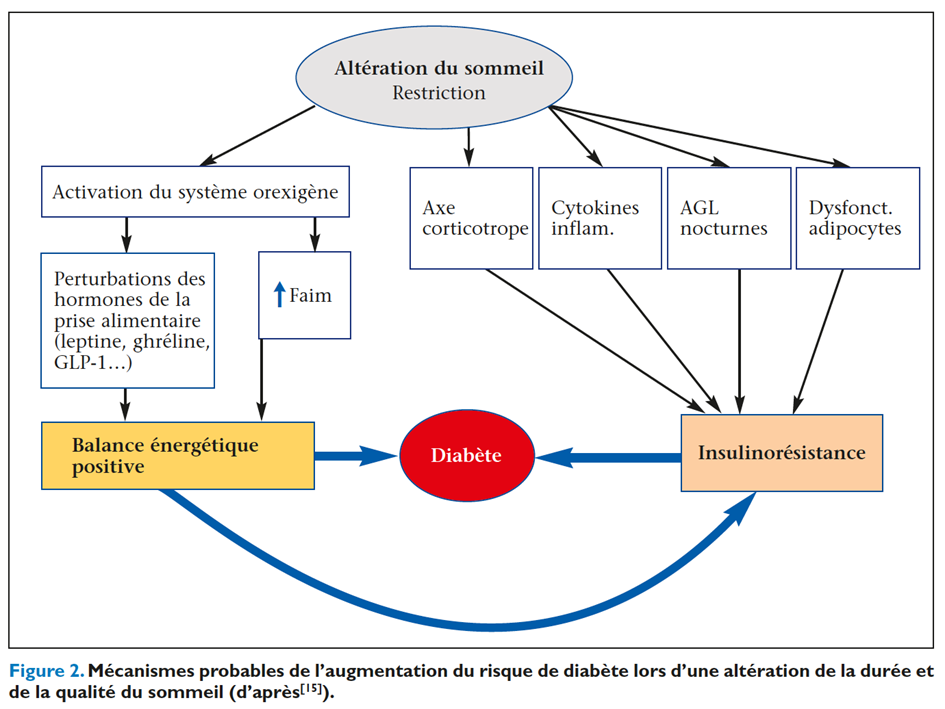
Mécanismes des altérations métaboliques induites par les troubles du sommeil (figure 2)
Les mécanismes des altérations métaboliques induites par les troubles du sommeil sont complexes et encore hypothétiques pour certains. La prise de poids, prélude du DT2, serait la conséquence d’une dérégulation du contrôle neuro-endocrinien de l’appétit. La privation de sommeil est associée à une hyperactivité du système orexine, à une activité excessive du système nerveux sympathique, à une augmentation des taux circulants de ghréline et à une diminution de la leptine (satiétogène), l’ensemble concourant à une augmentation de la prise alimentaire. Par ailleurs, la durée et la phase de sommeil ont un impact sur la sensibilité à l’insuline. L’hypoxie intermittente et la fragmentation du sommeil particulièrement fréquentes au cours du syndrome d’apnées obstructives du sommeil (SAOS) sont d’autres causes d’altération du métabolisme glucosé. Les épisodes d’éveil fréquents, l’hyperactivité sympa – thique et la perte de sommeil qui en résulte favoriseraient le développement de troubles métaboliques(13). Un conflit entre l’horloge biologique interne et l’horloge sociale externe en cas de travail posté ou lorsque les horaires de travail imposent un réveil précoce entraînant une dette de sommeil au fil de la semaine, semble également favoriser les troubles métaboliques(14,15).
Troubles du sommeil au cours du diabète
La prévalence de l’insomnie, manifestation majeure des troubles du sommeil, est augmentée chez les sujets atteints de DT2 puisqu’elle serait deux fois plus élevée chez les sujets DT2(16). Les symptômes du diabète en seraient la cause principale : la douleur chronique de la neuropathie périphérique, le syndrome des jambes sans repos, la nycturie et les épisodes hypoglycémiques sont tous susceptibles de perturber le sommeil. La qualité du sommeil est également médiocre chez 35 % des sujets DT1 contre 20 % chez des témoins appariés(17). La dépression plus fréquente chez les sujets diabétiques est un autre facteur d’altération du sommeil. De plus, le diabète lui-même a de multiples impacts sur le système nerveux central et autonome, affectant négativement le fonctionnement neurocomportemental et des neurotransmetteurs et les fonctions endocriniennes, pouvant ainsi conduire à des troubles du sommeil(18).
Syndrome d’apnées du sommeil et diabète
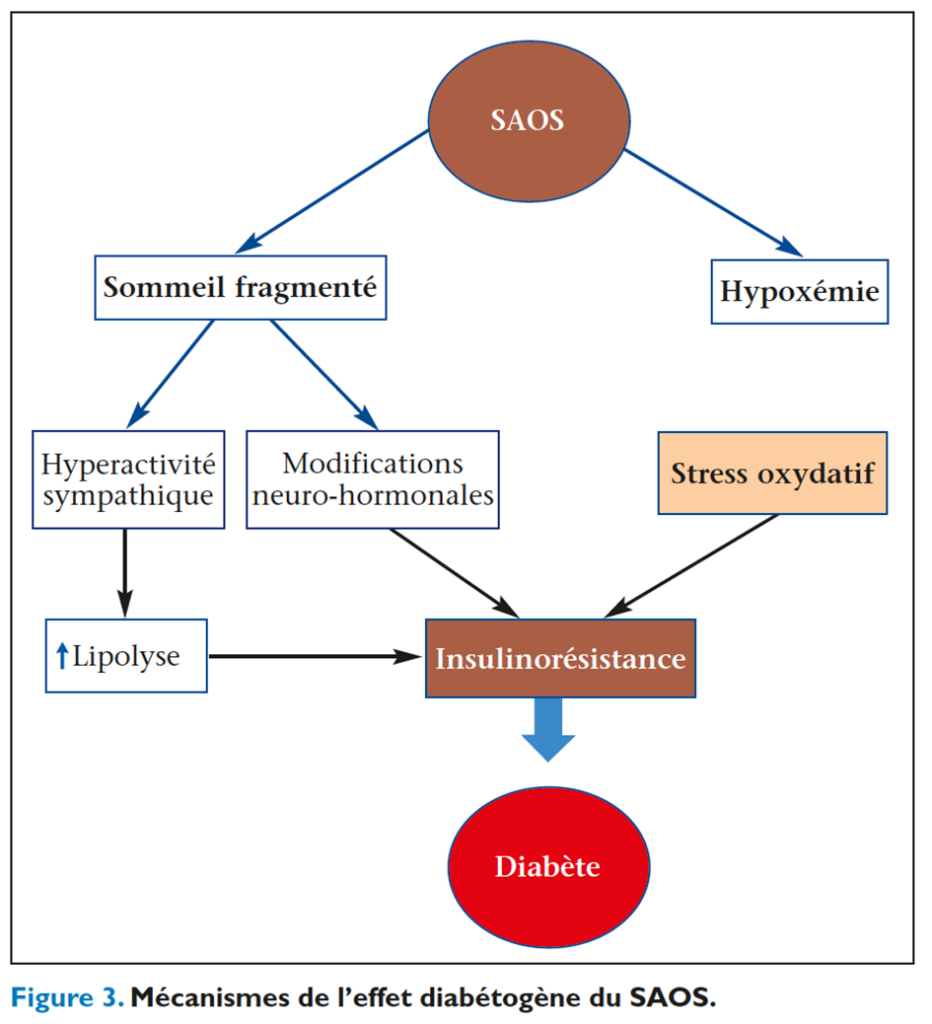
Le syndrome d’apnées-hypopnées obstructives du sommeil (SAOS), défini par la survenue d’au moins 5 épisodes par heure de sommeil de collapsus complet (apnées) ou incomplet (hypopnées) des voies aériennes supérieures, est responsable d’une hypoxie-hypercapnie et d’une hypersomnolence diurne. Le SAOS est fortement associé au surpoids et à l’obésité abdominale, fréquents dans le DT2. Facteur de risque cardiovasculaire indépendant, il est fréquemment associé à des troubles de la régulation glucosée et au diabète puisque près de 30 % des sujets ayant un SAOS présentent un DT2 et que la prévalence du SAOS est supérieure à 80 % chez les sujets DT2 obèses(19). L’hyperactivité sympathique, l’activation de l’axe corticotrope, la majoration du stress oxydatif et de l’inflammation, les modifications de la sécrétion des adipokines induites par les épisodes itératifs d’hypoxémie et la fragmentation du sommeil sont autant de facteurs contribuant à l’installation de l’insulinorésistance (figure 3)(20). Le SAOS pourrait également avoir un effet délétère sur l’efficacité du traitement antidiabétique et sur la progression des complications du DT2. Toutefois, si le traitement par ventilation en pression positive continue améliore considérablement la qualité de vie, il n’est pas prouvé qu’il a un impact décisif sur le contrôle glycémique. La relation entre le SAOS et l’HbA1c est inconstante, voire inexistante, bien que le traitement améliore la sensibilité à l’insuline indépendamment des modifications pondérales(21).
Sommeil et diabète de type 1
Les troubles du sommeil ont été assez peu explorés dans le DT1. Ils semblent néanmoins fréquents, mais leur impact direct sur le contrôle glycémique est incertain. En dehors de la crainte d’épisodes hypoglycémiques nocturnes qui perturbent le sommeil, ce sont surtout les troubles psychologiques anxiodépressifs fréquents au cours du DT1 qui sont à l’origine de troubles du sommeil. Leur amélioration par une prise en charge spécifique a des répercussions favorables à la fois sur le contrôle métabolique et la qualité du sommeil(22).

