Juliette EROUKHMANOFF, Alfred PENFORNIS, service de diabétologie sud-francilien, Corbeil-Essonnes
Nous avons vu que le principal déterminant des complications microangiopathiques du diabète de type 1 reste l’équilibre glycémique, évalué par le taux d’HbA1c ou le temps passé dans la cible (TIR), mais les facteurs psycho-sociaux et les TCA sont aussi des déterminants par un effet indirect via cet équilibre glycémique. L’autre déterminant incontournable est la durée du diabète, sachant que les années prépubertaires semblent, au pire, neutres de ce point de vue. Quelles sont, dans ce contexte, les perspectives de prise en charge ?
Recommandations de l’ISPAD concernant le dépistage des complications micro- et macrovasculaires chez l’enfant et l’adolescent ayant un DT1(1)
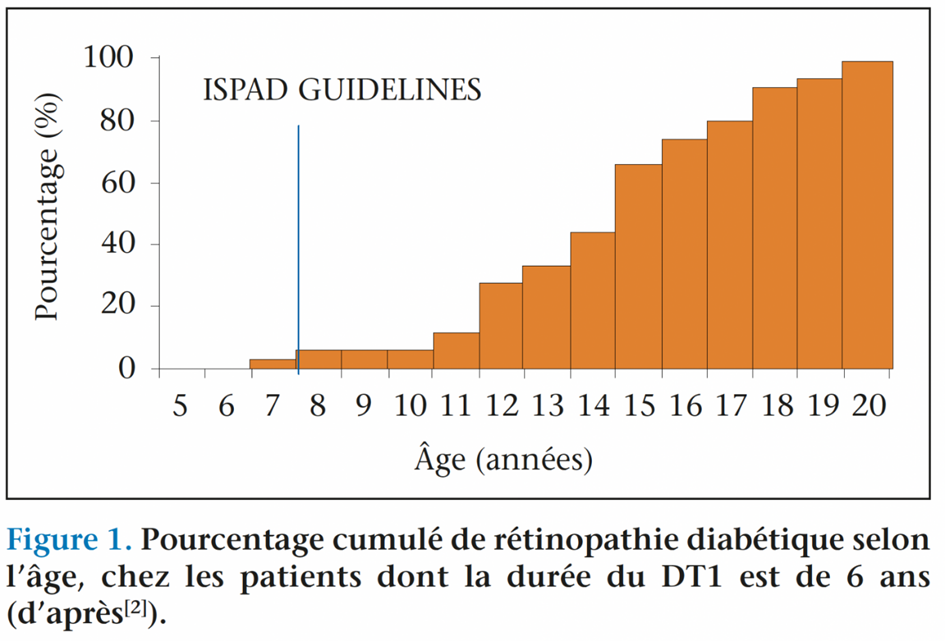
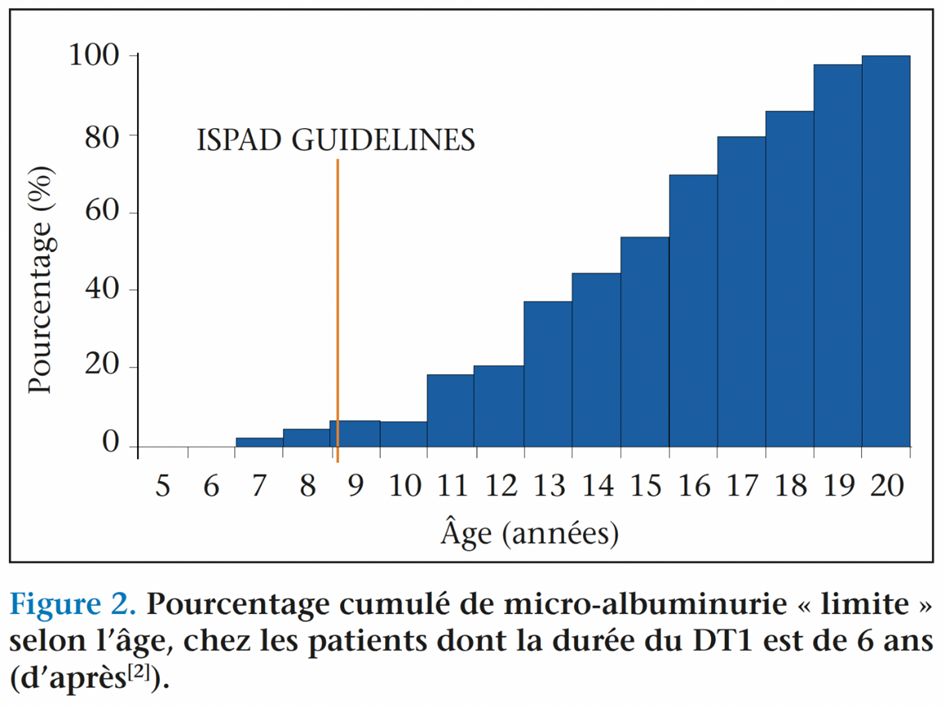
Les dernières recommandations de l’ISPAD en 2018 se sont alignées, pour les enfants vivant avec un DT1, aux objectifs glycémiques de l’adulte vivant avec un DT1, c’est-à-dire une HbA1c < 7 %, à condition que cela n’implique pas d’hypoglycémies sévères, ni de fréquentes hypoglycémies légères à modérées, ou un stress excessif pour l’enfant et la famille. Quand l’ADA recommande de débuter le dépistage de la rétinopathie diabétique (RD) 3 à 5 ans après le diagnostic chez des patients âgés d’au moins 9-10 ans, l’ISPAD a établi, quant à lui, pour le premier dépistage de la RD et de la néphropathie diabétique (ND), un âge de 11 ans quand la durée du diabète est d’au moins 2 ans et un âge de 9 ans pour une durée de diabète d’au moins 5 ans. Ce dépistage doit ensuite être poursuivi annuellement. Ceci permet ainsi, comme il est souligné dans la revue de Gallego et coll., à travers les résultats de l’étude Donaghue et coll.(3), à 6 ans d’évolution du diabète, de ne manquer « que » 5 % des RD et 3 % des microalbuminuries (figures 1 et 2)(2).
Enfin, les recommandations de l’ISPAD ont aussi ciblé les facteurs de risque cardiovasculaire dont l’impact peut être majeur sur la survenue de complications macro-angiopathiques. Ainsi, il est dit qu’une pression artérielle > 90e percentile doit faire envisager un traitement par IEC, un LDL-C > 100 mg/dL nécessi te une prise en charge hygiéno-diététique, et un LDLC > 130 mg/dL justifie un traitement par statine.
Ces recommandations sont moins strictes que les récentes recommandations de la Société européenne de cardiologie pour la prise en charge des dyslipidémies(4). En effet, les patients ayant un DT1 évoluant depuis plus de 20 ans sont maintenant classés dans la catégorie « à très haut risque cardiovasculaire », et leur objectif de LDL-C est < 0,55 g/L. Les patients ayant plus de 10 ans d’évolution de diabète ou avec un autre facteur de risque cardiovasculaire sont classés à « haut risque cardiovasculaire », et ont un objectif de LDL-C < 0,70 mg/dL. Ceci implique donc une prise en charge plus agressive chez ceux dont le diabète a été découvert dans l’enfance, avec une indication de traitement par statine plus large chez les jeunes adultes.
Difficultés d’équilibre du diabète durant l’adolescence
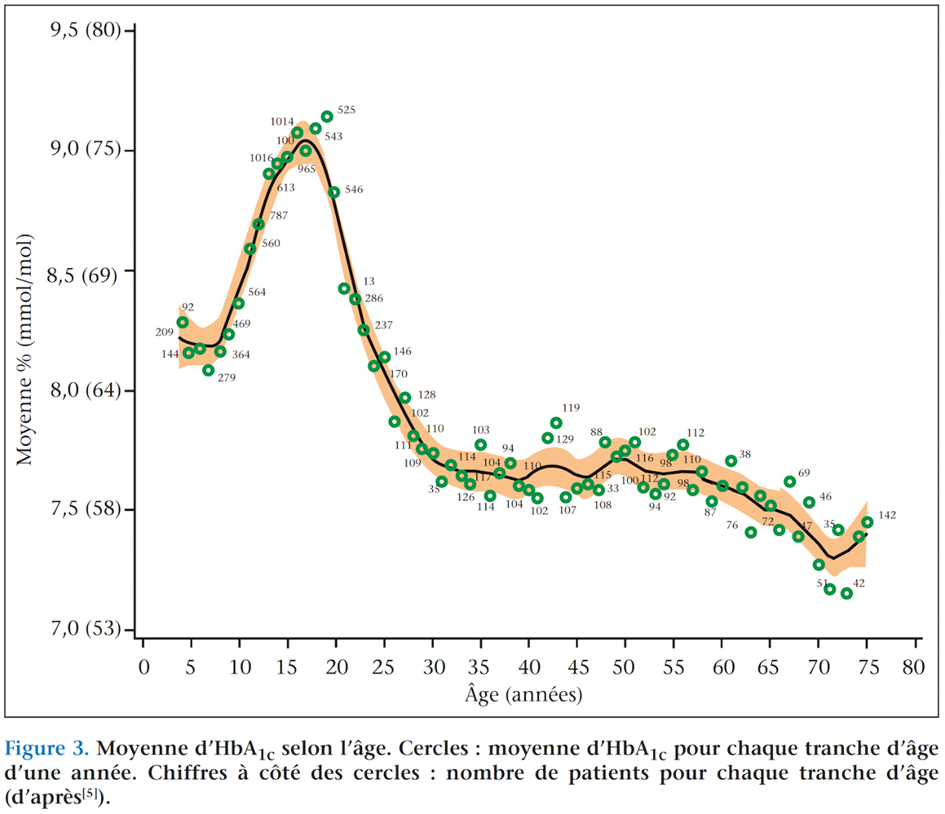
Dans une étude américaine de 2015 portant sur de grands registres de DT1, au sein d’une cohorte de 16 061 patients, l’évolution de l’HbA1c en fonction des différentes populations d’âge a été observée (figure 3)(5). On constate que la période de l’adolescence est la plus délicate en termes d’équilibre glycémique. En effet, l’HbA1c augmente franchement à partir de l’âge de 10 ans pour atteindre un pic à 9,2 % à l’âge de 19 ans. Dans cette même étude, on note que les tranches d’âge 13-17 et 18-25 ans sont celles dont les objectifs d’HbA1c fixés par l’ADA sont les moins souvent atteints.
Ces données ont été actualisées récemment en comparant 22 697 patients du registre datant de 2010-2012 et 22 529 patients de celui de 2016-2018(6). La moyenne d’HbA1c reste à peu près similaire dans toutes les tranches d’âge, excepté chez les adolescents et jeunes adultes où elle est plus élevée en 2016-2018 (9,3 % pour la tranche d’âge entre 15 et 18 ans) qu’en 2010-2012. Par ailleurs, toujours en comparant ces deux mêmes périodes, l’utilisation de la pompe à insuline à diffusion sous-cutanée et celle d’un système de mesure continue du glucose avaient augmenté (63 % vs 57 % et 30 % vs 7 %, respectivement), en particulier chez les enfants. Chez ces utilisateurs de nouvelles technologies, la moyenne des HbA1c était plus basse que chez ceux qui utilisaient un traitement par multi-injections et/ou un lecteur de glycémie capillaire.
Retarder, sinon prévenir l’apparition du diabète
Les causes de survenue du DT1 sont encore inconnues, mais nous savons qu’il existe une prédisposition génétique via le complexe majeur d’histocompatibilité HLA. Ainsi le risque de développer un diabète, lorsque l’on a un proche au 1er degré ayant un DT1 et que l’on partage un HLA à haut risque, est de 2,5 à 6,2 % selon l’étude allemande de Ziegler et coll. portant sur deux cohortes de 324 et 216 enfants(7). Un grand nombre d’études observationnelles et expérimentales essaient d’évaluer et de prévenir chez ces patients à risque la survenue du diabète.
Ainsi, une étude multicentrique, randomisée contre placebo, en double aveugle, réalisée en 2019 a testé un traitement de 14 jours par un anticorps monoclonal anti-CD3 (teplizumab) chez les personnes ayant un proche atteint de DT1(8). Au total, 76 individus, âgés de 8 à 49 ans, ayant au moins deux anticorps reliés au diabète et devant présenter un trouble de la régulation glycémique ont été inclus : 44 d’entre eux ont reçu le teplizumab et les 32 autres le placebo. La durée médiane de survenue du DT1 était allongée de deux fois dans le groupe teplizumab (48,4 mois) comparé au groupe placebo (24,4 mois). De plus, le DT1 a été diagnostiqué presque deux fois moins dans le groupe teplizumab (43 %) comparé au groupe placebo (72 %). Le hazard ratio pour le diagnostic de DT1 (teplizumab vs placebo) était de 0,41 (IC95% : 0,22-0,78, p = 0,006). Ceci laisse entrevoir des perspectives nouvelles de prise en charge anticipée des personnes ayant un « prédiabète » de type 1. Il reste cependant la question éthique centrale concernant le dépistage de ces individus sains et la balance bénéfice-risque de ce traitement préventif.
Intérêt des nouvelles technologies : quid du pancréas artificiel ?
Le pancréas artificiel, ou boucle fermée (BF), a démontré son efficacité en termes d’équilibre glycémique chez l’adulte, comme l’atteste la récente étude française DIABELOOP WP7 ayant inclus 63 patients avec un DT1, en cross-over, suivis pendant 12 semaines en vraie vie(9). Ainsi, le temps passé dans la cible 70-180 mg/dL a été amélioré de 9,2 % et le temps passé en hypoglycémie était réduit de moitié. Ces chiffres étaient d’autant plus importants lorsque, dans la période contrôle, les patients étaient plus longtemps en hyperglycémie ou en hypoglycémie. Cependant, Berget et coll. ont rapporté dans une étude sur 92 adolescents de 15,7 ans en moyenne avec une HbA1c en moyenne à 8,8 %, suivis pendant 6 mois, que ce système était abandonné dans un tiers des cas et que ceux qui continuaient ne passaient pas tout leur temps en BF, réduisant ainsi l’amélioration de l’équilibre glycémique(10). En revanche, chez le très jeune enfant, la BF, en plus de sa sécurité d’emploi, a montré un bénéfice certain dans le contrôle glycémique, en particulier nocturne, avec un faible risque d’hypoglycémie, comme le montre une étude américaine regroupant 24 enfants vivant avec un DT1, âgés de 1 à 7 ans et une HbA1c moyenne de 7,4 %(11). Des résultats similaires ont été rapportés dans une étude multicentrique, randomisée ouverte, durant 16 semaines, incluant des enfants âgés de 6 à 13 ans, comparant un système de BF et une pompe à insuline avec capteur en boucle ouverte(12). Ces innovations semblent ainsi permettre, pour les personnes les plus assidues dans la gestion de leur diabète au quotidien, d’atteindre leur objectif d’équilibre glycémique, tout en offrant une amélioration de leur qualité de vie.
Amélioration de la prise en charge sociale du patient et de sa famille
Le contexte socio-économique du patient et de sa famille a une grande importance dans l’équilibre du diabète et la survenue de complications. Le système de Sécurité sociale qui existe en France permet d’assurer un accès aux soins pour tous. Cependant, un manque d’encadrement des personnes atteintes de maladie chronique comme le diabète de type 1, impliquant une gestion « pointue » du traitement au quotidien, peut être responsable d’un mauvais équilibre et ainsi d’une qualité de vie amoindrie pour ces personnes. La mise en place de mesures telles qu’un véritable relais ville-hôpital, l’augmentation du nombre de postes médicaux ou paramédicaux permettant un suivi rapproché, ou encore l’organisation d’échanges entre pairs, permettant de favoriser l’entraide dans les situations les plus difficiles, sont autant de solutions à développer pour éviter la survenue de complications à court et à long terme chez ces patients les plus vulnérables.

Références
Cliquez sur les références et accédez aux Abstracts sur
1. Hanas R et al. ISPAD clinical practice consensus guidelines 2009 compendium. Introduction. Pediatr Diabetes 2009 ; 10 (Suppl 12) : 1-2.
2. Gallego PH et al. Identifying children at particular risk of long-term diabetes complications. Pediatr Diabetes 2007 ; 8 (Suppl 6) : 40-8.
3. Donaghue KC et al. Prevalence of diabetes complications 6 years after diagnosis in an incident cohort of childhood diabetes. Diabet Med 2005 ; 22 : 711-8.
4. ESC Committee for Practice Guidelines (CPG), ESC National Cardiac Societies. 2019 ESC/EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. Atherosclerosis 2019 ; 290 : 140-205. 5. Miller KM et al. Current state of type 1 diabetes treatment in the US: updated data from the T1D Exchange clinic registry. Diabetes Care 2015 ; 38: 971-8.
6. Foster NC et al. State of type 1 diabetes management and outcomes from the T1D Exchange in 2016-2018. Diabetes Technol Ther 2019 ; 21 : 66-72.
7. Ziegler AG et al. Accelerated progression from islet autoimmunity to diabetes is causing the escalating incidence of type 1 diabetes in young children. J Autoimmunity 2011 ; 37 : 3-7.
8. Herold KC et al. An anti-CD3 antibody, teplizumab, in relatives at risk for type 1 diabetes. N Engl J Med 2019 ; 381 : 603-13.
9. Benhamou PY et al. Closed-loop insulin delivery in adults with type 1 diabetes in real-life conditions: a 12-week multicentre, open-label randomised controlled crossover trial. The Lancet Digital Health 2019 ; 1 : e17-25.
10. Berget C et al. Six months of hybrid closed loop in the real-world: An evaluation of children and young adults using the 670G system. Pediatr Diabetes 2020 ; 21 : 310-8.
11. Tauschmann M et al. Home use of day-and-night hybrid closed-loop insulin delivery in very young children: a multicenter, 3-week, randomized trial. Diabetes Care 2019 ; 42 : 594-600.
12. Breton MD et al. A randomized trial of closed-loop control in children with type 1 diabetes. N Engl J Med 2020 ; 383 : 836-45.